细胞侵袭是一个重要的生理现象,不仅在胚胎发育、免疫过程和伤口愈合中起着关键作用,也对癌细胞的转移至关重要。研究细胞侵袭的实验通常使用传统的侵袭实验,但基于动物的ECM存在挑战。VitroGel 水凝胶是一种合成的无动物源水凝胶,具有可调生物物理和生化特性,为细胞迁移研究提供了便利并支持高通量操作。VitroGel已在乳腺癌、前列腺癌和黑色素瘤等细胞侵袭实验中得到成功应用,为细胞侵袭和运动研究提供了强大工具。
基于 VitroGel 的细胞侵袭实验试剂盒评估高度侵袭性的胶质母细胞瘤细胞 U87-MG 的侵袭性,包括“即用型”和可调谐的“高浓度”试剂盒,研究了水凝胶机械强度和功能配体对细胞侵袭的影响,还描述了一种新颖独特的使用该试剂盒创建的侵袭实验,能将趋化因子和药理试剂嵌入基质以评估趋化作用。
材料和方法
细胞培养
U87-MG胶质母细胞瘤细胞在补充有10%胎牛血清(FBS)、1%青霉素-链霉素和1%谷氨酰胺的最低必需培养基(MEM 1X)中培养。当细胞达到80-90%汇合时进行传代。
细胞侵袭实验试剂盒:
即用型,细胞侵袭实验试剂盒:
VitroGel细胞侵袭试剂盒(Cat#IA-VHM01-1P)
可调节,高浓度细胞侵袭实验试剂盒:
VitroGel 3D细胞侵袭试剂盒(Cat#IA-HC001-1P)
VitroGel RGD细胞侵袭试剂盒(Cat#IA-HC003-1P)
VitroGel MMP细胞侵袭试剂盒(Cat#IA-HC010-1P)
细胞侵袭的其他材料
1X磷酸盐缓冲盐水(1XPBS)
4%甲醛
台盼蓝染色剂
棉签
镊子
甲醇
结晶紫染色剂
微量移液器和低保留移液器吸头
Zeiss显微镜
Image J软件
方法
1. VitroGel 细胞侵袭实验试剂盒(即用型)
1) 使VitroGel水凝胶基质和培养基达到室温。
2) 向500μL基础细胞培养基中加入1mL VitroGel水凝胶基质溶液,并轻轻吹打5-10次以均匀混合混合物。(保持VitroGel水凝胶基质溶液和基础细胞培养基的2:1体积比混合)。*如果使用低盐浓度的细胞培养基,例如RMPI 1640培养基,请考虑使用1:1体积比混合。(例如,将500μL VitroGel水凝胶溶液与500μL细胞培养基混合)。注意:如果需要向水凝胶基质中添加补充剂,如细胞因子、生长因子、趋化因子或化学试剂,请将补充剂的3倍所需浓度添加到细胞培养基中。然后可以将细胞培养基与VitroGel水凝胶溶液混合,以使水凝胶基质中的最终补充剂浓度为1X。(例如:制备含有30ng/mL细胞因子的培养基。将VitroGel水凝胶基质溶液与培养基以2:1体积比混合,以获得水凝胶基质内10ng/mL细胞因子的最终浓度)。
3) 向每个插入物中加入100μL水凝胶混合物,并确保每个插入物表面均匀分布有水凝胶。注意:如果实验需要更薄的凝胶来评估侵袭,请将每个插入物的水凝胶体积调整为50-100μL。
4) 在室温下让水凝胶混合物固化20分钟,然后在水凝胶顶部加入细胞。
5) 在所需的培养基(即无血清培养基)中制备细胞悬液,浓度为1-3 x 10*5细胞/mL,并在水凝胶顶部加入100μL细胞悬液。可选的接种方法:为确保细胞接种在水凝胶表面,首先在水凝胶顶部加入50%的培养基(无细胞)。等待5-10分钟,然后在水凝胶顶部加入剩余50%的含有细胞的培养基。(例如,首先加入50μL培养基(无细胞);等待10-5分钟;然后在顶部加入50μl含有2-6 x 10*6细胞/mL的培养基)。
6) 制备含有感兴趣因素(即趋化因子、细胞因子或血清)的细胞培养基,并向外孔中加入500μL细胞培养基。
7) 将细胞在湿润的细胞培养箱中于37°C下孵育。
2. 可调节,高浓度细胞侵袭实验试剂盒
以下协议适用于所有VitroGel高浓度细胞侵袭实验试剂盒版本。下面以VitroGel RGD细胞侵袭实验试剂盒为例。
1) 使VitroGel RGD水凝胶和基础培养基达到室温。
2) 用VitroGel 稀释溶液将VitroGel RGD水凝胶溶液稀释至所需浓度。参考表1获取不同比例的推荐体积。

表1:高浓度水凝胶不同稀释比例的VitroGel水凝胶溶液、稀释溶液和细胞培养基的体积。
3) 将稀释后的水凝胶溶液与基础培养基以4:1的比例混合。参考表1以获取混合的建议体积。提示:如果您需要向水凝胶基质中添加细胞因子、生长因子、趋化因子或化学试剂等补充剂,将5倍浓度的补充剂加入细胞培养基中。然后可以将细胞培养基与稀释的VitroGel水凝胶溶液以4:1的比例混合,以在水凝胶基质中获得1倍的最终补充浓度。(例如:准备含有50 ng/mL细胞因子的培养基。将稀释后的VitroGel水凝胶溶液与培养基以4:1的体积/体积混合比混合,以在水凝胶基质中获得10 ng/mL细胞因子的最终浓度)
4) 向每个插入物中加入 100μL 水凝胶混合物,并确保每个插入物表面均匀覆盖有水凝胶。
注意:如果实验需要更薄的凝胶来评估侵袭,请将每个插入物的水凝胶体积调整为 50-100μL。
5) 在室温下让水凝胶混合物固化 20 分钟,然后在水凝胶顶部加入细胞。
6) 在所需的培养基(即无血清培养基)中制备细胞悬液,浓度为 1-3 x 10*5 细胞/mL,并在水凝胶顶部加入 100μL 细胞悬液。
可选的接种方法:为确保细胞接种在水凝胶表面,首先在水凝胶顶部加入 50%的培养基(无细胞)。等待 5-10 分钟,然后在水凝胶顶部加入剩余 50%的含有细胞的培养基。(例如,首先加入 50μL 培养基(无细胞);等待 10-5 分钟;然后在顶部加入 50μl 含有 2-6 x 10*6 细胞/mL 的培养基)。
7) 制备含有感兴趣因素(即趋化因子、细胞因子或血清)的细胞培养基,并向外孔中加入 500μL 细胞培养基。
8) 将细胞在湿润的细胞培养箱中于 37°C 下孵育。
阅读完整的协议请点击这里:https://www.thewellbio.com/product/vitrogel-cell-invasion-assay-kit/
结果
1. VitroGel 细胞侵袭实验试剂盒(即用型)
U87-MG 胶质母细胞瘤细胞向血清梯度的侵袭
即用型水凝胶-细胞侵袭实验试剂盒:
VitroGel 细胞侵袭实验试剂盒(CAT #IA-VHM01-1P)
插入物:VitroGel 水凝胶基质与 MEM 基础培养基以 2:1 的体积比混合
外孔:MEM 基础培养基(无血清)或 MEM 含 20%FBS
细胞:U87-MG 细胞(每个插入物 3.8 x 10*4 细胞)
细胞孵育时间:48 小时
为了进行传统的侵袭实验,将 VitroGel 水凝胶基质与 MEM 基础培养基以 2:1 的体积比混合。将水凝胶混合物(100μL)加入每个插入物中,然后在室温下孵育 20 分钟以使水凝胶固化。然后将 U87-MG 细胞(每个插入物 3.8 x 10*4 细胞)重悬于 MEM 基础培养基中,并放置在涂层插入物的顶部。向外孔中补充 MEM 基础培养基或补充有 20%FBS 的 MEM 培养基(每孔 500μL,图 1A)。将培养物在 37°C 下孵育 48 小时。在细胞孵育后,我们进行了结晶紫染色以可视化细胞侵袭(图 1B-C)。
正如预期的那样,与在无血清培养基中培养的细胞相比,暴露于补充有 20%FBS 的培养基中的 U87-MG 细胞显着侵袭了水凝胶基质(图 1B-C)。这些发现表明,VitroGel 细胞侵袭实验试剂盒是一种可行的工具,可用于检查由血清梯度引起的细胞侵袭。
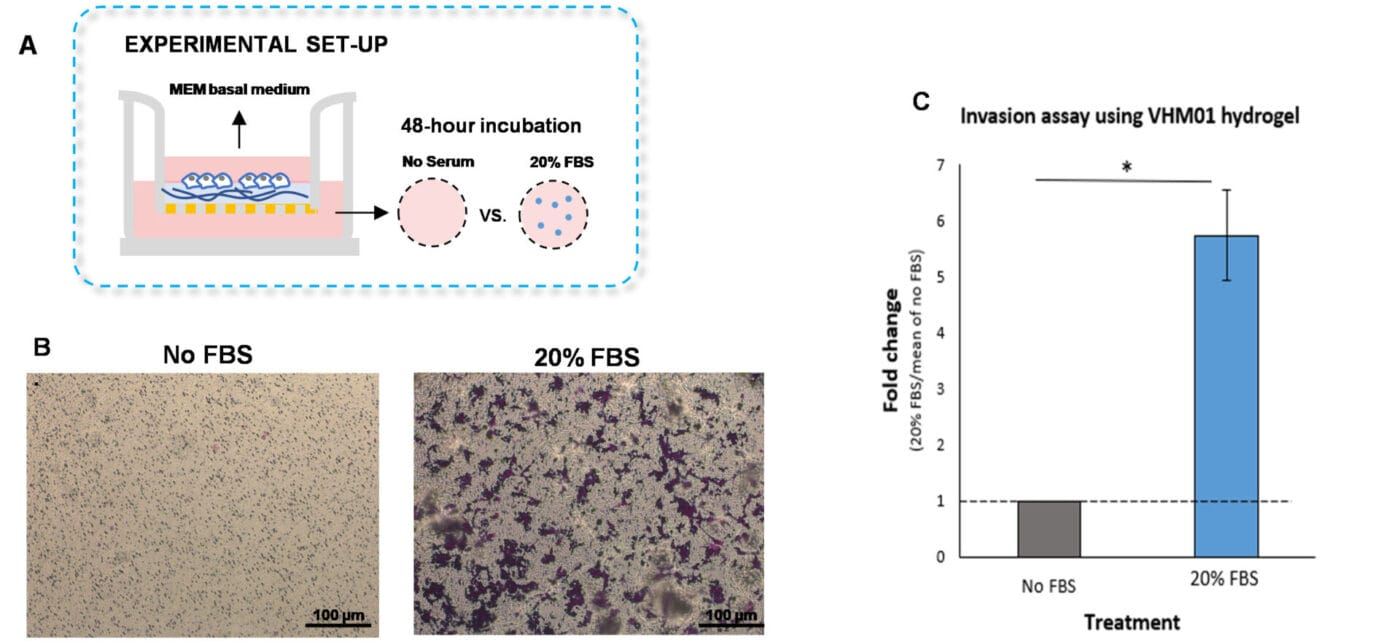
图 1. U87-MG 胶质母细胞瘤细胞通过 VitroGel 水凝胶基质的侵袭由血清梯度引起。
A. 展示侵袭实验细胞培养设置的示意图。B. 通过进行结晶紫染色,然后进行光学显微镜观察,可视化 U-87MG 细胞侵袭。图像显示了对照组(无 FBS)和 20%FBS 条件下的膜插入物。使用 Zeiss 显微镜在 10X 放大倍数下获得图像。C. 对照组和 20%FBS 组之间 U87-MG 细胞侵袭的倍数变化。将对照组归一化为 1。星号(*)表示 p<0.05。
通过将细胞因子或趋化因子嵌入 VitroGel 水凝胶基质中来评估细胞侵袭
即用型水凝胶-细胞侵袭实验试剂盒:
VitroGel 细胞侵袭实验试剂盒(CAT #IA-VHM01-1P)
插入物:VitroGel 水凝胶基质与 MEM 基础培养基混合,有或无 TGF-β1
外孔:MEM 基础培养基(无血清)或 MEM 含 20%FBS
细胞:U87-MG 细胞(每个插入物 3 x 10*4 细胞)
细胞孵育时间:24 小时
传统的侵袭实验经常用于检查细胞向位于外孔中的趋化因子或细胞因子的侵袭。我们通过将细胞因子,转化生长因子(TGF)-β1 嵌入水凝胶中而不是将其放置在外孔中来适应这种方法。此外,将 VitroGel 水凝胶基质与补充有 TGF-β1(30ng/mL)的 MEM 基础培养基或与 MEM 基础培养基以 2:1 的比例混合(图 2A)。将水凝胶混合物(100μL)均匀地加入插入物中,并在室温下固化 20 分钟。然后将细胞(3 x 10*4 )添加到水凝胶顶部,并向外孔中填充 MEM 基础培养基或含有 20%FBS 的 MEM。将培养物在 37°C 下孵育 48 小时,然后进行结晶紫染色以评估细胞侵袭。
为了确定细胞侵袭是否是由于 TGF-β1 而不是由于外孔中的 FBS 引起的,我们建立了一个对照组,其中水凝胶未补充 TGF-β1,但外孔中含有 20%FBS(图 2A)。我们观察到增强的外孔,这与图 1B 和 1C 中显示的结果一致。然而,与外孔中含有无血清培养基或含 FBS 的培养基的细胞相比,将 TGF-β1 添加到水凝胶中增加了 U87-MG 细胞通过水凝胶的侵袭(图 2B-C)。这些发现表明,将细胞因子或趋化因子嵌入 VitroGel 水凝胶中是一个很好的平台,可以更好地评估趋化作用。
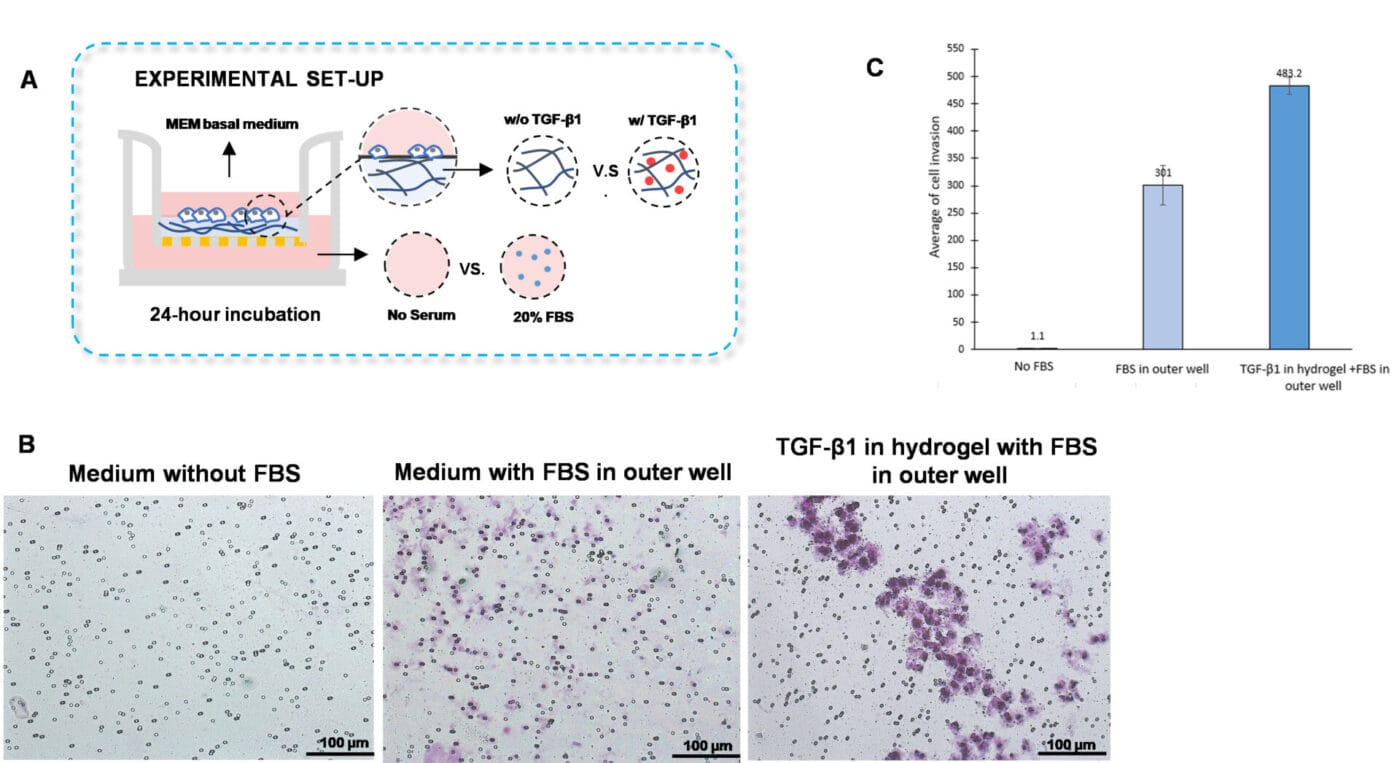
图 2. TGF-β1 在 VitroGel 水凝胶基质内诱导 U87-MG 胶质母细胞瘤细胞的侵袭。
A. 展示侵袭实验设置的可视化表示。B. 光学显微镜图像显示在不同组中进行结晶紫染色后的细胞侵袭。使用 Zeiss 显微镜在 10X 放大倍数下获得图像。C. 每个实验条件下 U87-MG 细胞侵袭的平均值。
2. VitroGel 高浓度细胞侵袭实验试剂盒(可调节)
不同水凝胶机械强度对 U87-MG 胶质母细胞瘤细胞侵袭的影响
可调谐水凝胶-高浓度细胞侵袭实验试剂盒:
? VitroGel RGD 细胞侵袭实验试剂盒(CAT #IA-HC003-1P)
? 插入物:VitroGel RGD 水凝胶以 1:1、1:3 和 1:5 稀释比例
? 外孔:MEM 基础培养基(无血清)或 MEM 含 20%FBS
? 细胞:U87-MG 细胞(每个插入物 3 x 10*4 细胞)
? 细胞孵育时间:24 小时
VitroGel 高浓度水凝胶的独特性质是,其机械强度可以通过使用 VitroGel 稀释溶液进行调整,以适应不同的体外和体内方法。根据稀释比例,VitroGel 高浓度水凝胶可以实现 10-4000Pa 的机械强度(弹性模量)。因此,调节 VitroGel 高浓度水凝胶的机械强度是一种可以适应并应用于传统侵袭实验的方法。
评估水凝胶的力学强度是否影响细胞侵袭,我们使用以下比例将VitroGel RGD与VitroGel稀释液稀释: 1:1、1:3和1:5(图3A)。 水凝胶混合物加入到插入物中,在室温下孵育20分钟,悬浮在无血清培养基中的U87-MG胶质母细胞瘤细胞放置在插入物顶部。 外部孔用无血清培养基或含有20% FBS的培养基覆盖。 然后,细胞在37°C下孵育24小时,随后使用结晶紫染色检查细胞侵袭。
研究结果显示,增加VitroGel RGD的稀释比允许细胞侵入水凝胶基质,当化学引诱物,如含有血清的培养基放置在外部孔时(图3 B-C)。 具体地,我们证明VitroGel RGD与VitroGel稀释液的1:5稀释对水凝胶基质的细胞侵袭最高,其次是1:3和1:1的稀释比(图3 B-C)。 这些发现表明,调整VitroGel RGD的力学强度会影响细胞对FBS梯度的运动能力。
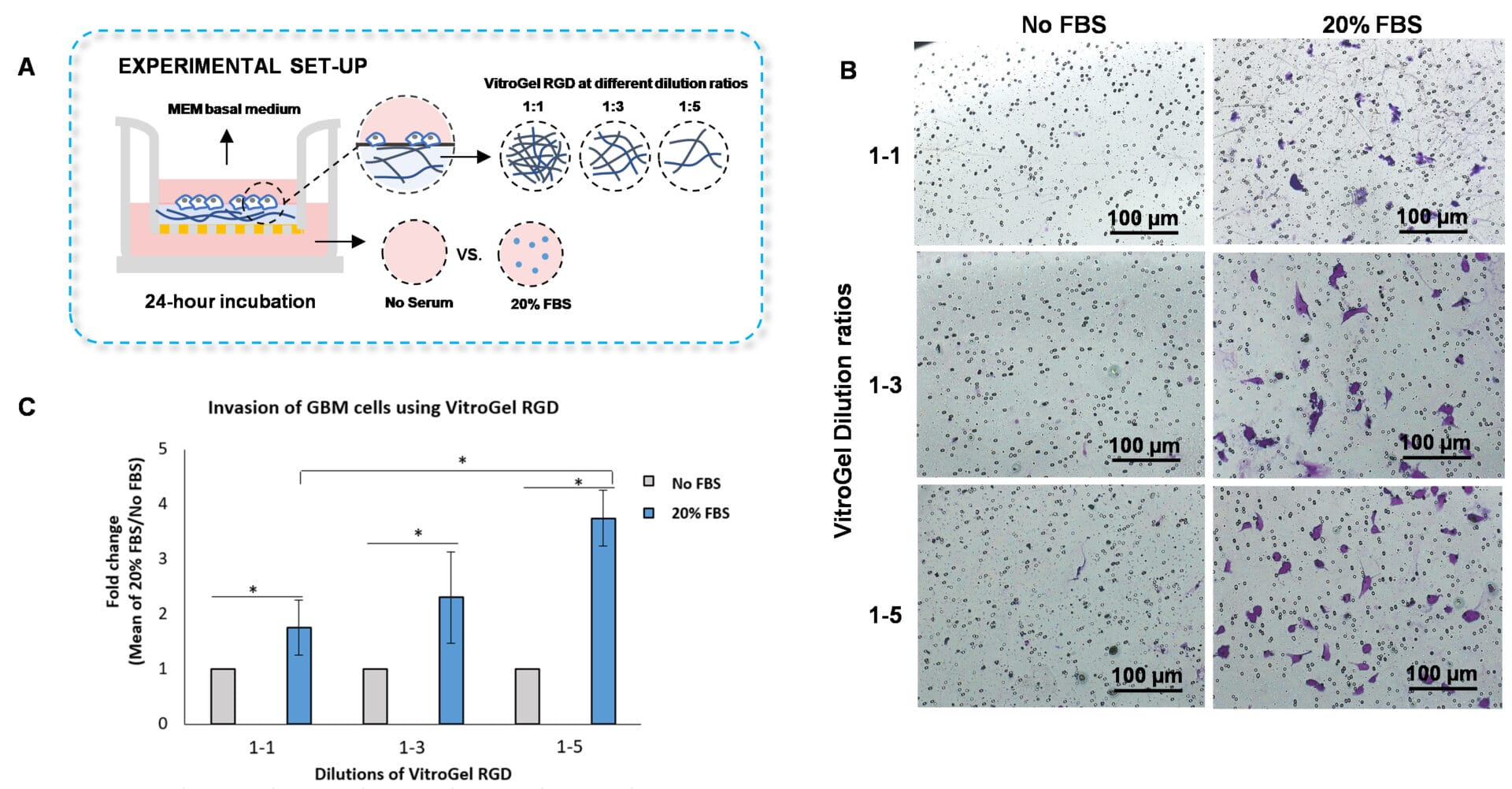
图 3. 使用 VitroGel RGD 高浓度水凝胶对 U87-MG 胶质母细胞瘤(GBM)细胞的侵袭。
A. 实验设置的示意图。B. 显微镜图像显示 U87-MG 胶质母细胞瘤细胞通过 VitroGel RGD 的侵袭。将水凝胶用 VitroGel 稀释溶液以 1:1、1:3 和 1:5 的比例稀释。使用 Zeiss 显微镜在 10X 放大倍数下获得图像。C. 对于 VitroGel RGD 的每种稀释,FBS 组相对于无 FBS 组的细胞侵袭倍数变化。将无 FBS 组归一化为 1。星号表示 p < 0.05。
向 VitroGel 高浓度水凝胶中添加细胞因子、趋化因子和生长因子以研究细胞侵袭
可调谐水凝胶-高浓度细胞侵袭实验试剂盒:
VitroGel 3D 细胞侵袭实验试剂盒(CAT #IA-HC001-1P)
VitroGel RGD 细胞侵袭实验试剂盒(CAT #IA-HC003-1P)
插入物:VitroGel 3D 和 VitroGel RGD 水凝胶以 1:3 稀释比与 TGF-β1 或无 TGF-β1
外孔:MEM 基础培养基(无血清)或 MEM 含 20%FBS
细胞:U87-MG 细胞(每个插入物 3 x 10*4 细胞)
细胞孵育时间:48 小时
VitroGel 高浓度水凝胶易于使用,可针对各种实验应用进行定制,包括传统的侵袭实验。与 VitroGel 即用型水凝胶类似,细胞因子、趋化因子或生长因子可以掺入 VitroGel 高浓度水凝胶中以测定细胞侵袭。因此,我们通过将 TGF-β1 嵌入 VitroGel 3D 和 VitroGel RGD 高浓度水凝胶中来评估 U87-MG 胶质母细胞瘤细胞对细胞因子梯度的侵袭。
为了检查 U87-MG 胶质母细胞瘤细胞向 TGF-β1 梯度的侵袭,我们首先用 VitroGel 稀释溶液对每种水凝胶进行 1:3 稀释。随后,将水凝胶混合物与 MEM 基础培养基或补充有 TGF-β1(30ng/mL)的 MEM 基础培养基以 4:1 的比例混合。将稀释的水凝胶添加到插入物中,并允许固化 20 分钟,然后将细胞悬液添加到水凝胶的顶部。在外孔中放置无血清培养基或补充有 20%FBS 的培养基。将细胞在 37°C 下孵育 48 小时。之后,通过进行结晶紫染色来评估细胞侵袭。
TGF-β1 在水凝胶中的添加刺激了 U87-MG 胶质母细胞瘤细胞的侵袭。此外,我们观察到,与含有 TGF-β1 的 VitroGel 3D 相比,将 TGF-β1 嵌入 VitroGel RGD 中有利于细胞侵袭。与图 3B 和 3C 中的发现一致,我们表明,在外孔中含有血清的培养基促进了水凝胶中不含 TGF-β1 的组中的细胞侵袭。总之,结果表明,细胞因子、趋化因子或生长因子可以掺入 VitroGel 高浓度水凝胶中以评估细胞侵袭。
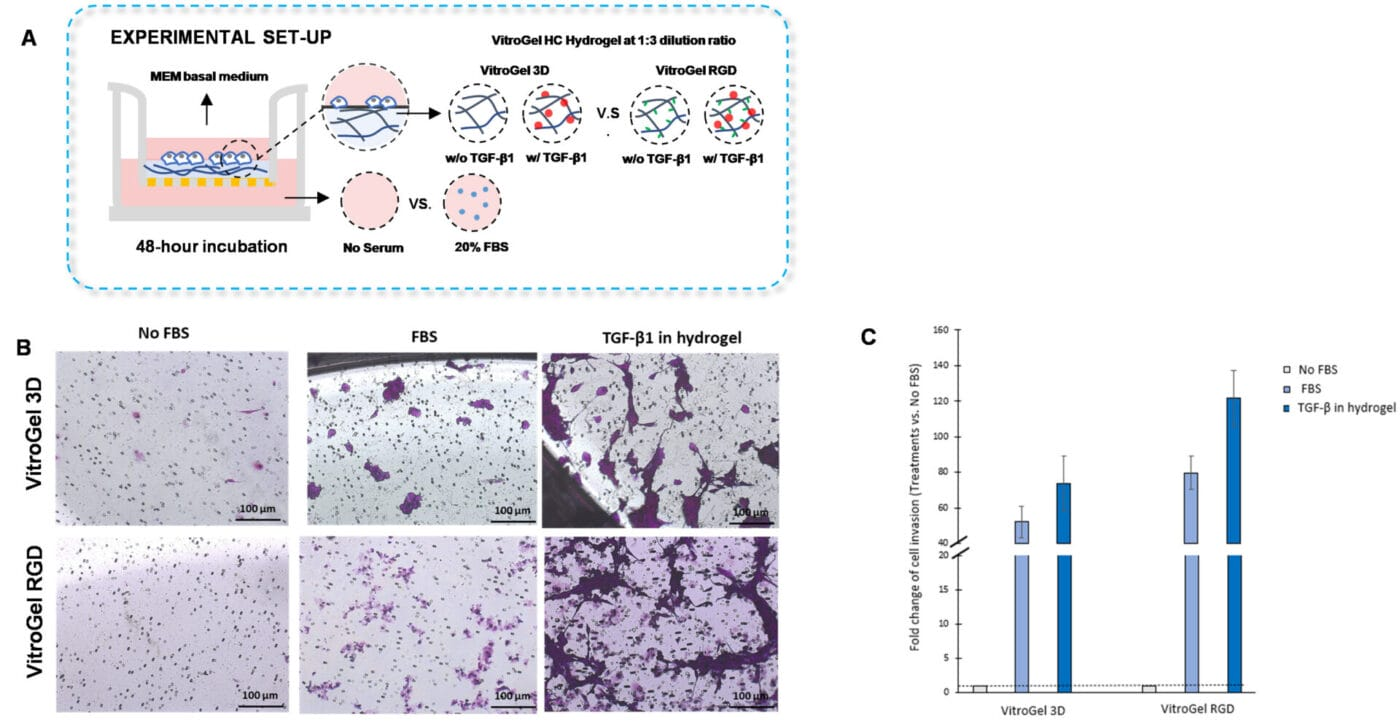
图 5. TGF-β1 在 VitroGel 3D 和 VitroGel RGD 中促进 U87-MG 胶质母细胞瘤细胞的侵袭。
A. 实验设置的可视化表示。培养物孵育 48 小时。B. 显微镜图像显示 U87-MG 胶质母细胞瘤细胞通过 VitroGel 3D 和 RGD 的侵袭。每种水凝胶用 VitroGel 稀释溶液以 1:3 的比例稀释,然后与 MEM 基础培养基或含有 TGF-β1(30ng/mL)的 MEM 以 4:1 的比例混合。使用 Zeiss 显微镜在 10X 放大倍数下获得图像。C. 对于每种水凝胶,TGF-β1 在水凝胶和 FBS 组相对于无 FBS 组的细胞侵袭倍数变化。将无 FBS 组归一化为 1。
结论
本应用说明中呈现的数据表明,无论是现成的VitroGel 水凝胶基质,还是可调节的VitroGel “高浓度”水凝胶均可用于传统的侵袭试验。
VitroGel水凝胶基质是研究人员的绝佳选择,其实验不需要调整水凝胶的力学强度或特定的生物功能配体来研究细胞侵袭。相反,VitroGel高浓度水凝胶是可调节的;因此,当与VitroGel稀释液结合时,弹性模量的力学强度可调整至4000帕。我们的研究结果显示,增加高浓度VitroGel水凝胶(VitroGel RGD与VitroGel稀释液)的稀释比增强了胶质母细胞瘤细胞的侵袭,表明力学强度影响细胞侵袭。此外,VitroGel高浓度水凝胶带有特定的生物功能配体,如MMPs、RGD等,允许评估这些因素在细胞侵袭中的作用。这项研究表明,水凝胶中的生物功能配体影响胶质母细胞瘤细胞的侵袭。
正如先前提到的,可与现成的VitroGel 细胞侵袭试剂盒和可调节的VitroGel 高浓度细胞侵袭试剂盒一起使用的新颖而独特的应用是添加细胞因子、趋化因子、生长因子或药理剂。因此,我们采用了这种方法来评估胶质母细胞瘤细胞对水凝胶内TGF-β1梯度的侵袭。我们的研究结果表明,水凝胶中的TGF-β1刺激了胶质母细胞瘤细胞的侵袭,从而证明了在VitroGel水凝胶中结合因子是评估趋化作用的强大方法。总的来说,基于VitroGel的细胞侵袭试剂盒构成了一个功能强大且灵活的系统,可适用于各种侵袭试验应用场景。
链接到使用的产品
细胞侵袭实验试剂盒:
即用型,细胞侵袭实验试剂盒:
VitroGel细胞侵袭试剂盒(Cat#IA-VHM01-1P)
可调节,高浓度细胞侵袭实验试剂盒:
VitroGel 3D细胞侵袭试剂盒(Cat#IA-HC001-1P)
VitroGel RGD细胞侵袭试剂盒(Cat#IA-HC003-1P)
VitroGel MMP细胞侵袭试剂盒(Cat#IA-HC010-1P)
参考文献
1. Mahauad-Fernandez WD, Okeoma CM (2018). B49, a BST-2-based peptide, inhibits adhesion and growth of breast cancer cells. Sci Rep 8, 4305. https://doi.org/10.1038/s41598-018-22364-z
2. Di Donato, M, Cernera G, Migliaccio A, Castoria G (2019). Nerve Growth Factor induces proliferation and aggressiveness in prostate cancer cells. Cancers, 11, 784. https://doi.org/10.3390/cancers11060784
3. Ramos RI, Bustos MA, Wu J, Jones P, Chang SC, Kiyohara E, Tran K, Zhang X, Stern SL, Izraely S, Sagi-Assif O, Witz IP, Davies MA, Mills GB, Kelly DF, Irie RF, Hoon DSB (2020). Upregulation of cell surface GD3 ganglioside phenotype is associated with human melanoma brain metastasis. Mol Oncol 14, 1760–1778. https://doi.org/10.1002/1878-0261.12702
3D培养/类器官培养专家,艾美捷科技!
点击下方单页图片,获得3D培养于类器官培养指南




 经营性网站备案信息
经营性网站备案信息 鄂公网安备42018502007175
鄂公网安备42018502007175