在过去几年里,围绕肠道微生物群与人类整体健康之间的关系进行了大量讨论并发表了许多研究。最近的研究显示肠道微生物组与肥胖、2型糖尿病、结肠癌等疾病存在关联1。
首先让我们讨论一下肠道微生物组的构成。肠道微生物组由100万亿微生物细胞组成,主要包括超过300种不同的细菌物种,以及病毒、真菌和寄生虫234。了解这些微生物细胞及其基因组成可以帮助我们了解疾病相关性、免疫系统调节和代谢功能。在这篇文章我们将讨论如何利用宿主和微生物的RNA、DNA和代谢产物来评估人类健康状况。
那么,如何开始调查您的肠道微生物呢?无创检测肠道的方法是通过粪便。粪便中的RNA和DNA可用于定量PCR分析、宏基因组测序,甚至代谢组学。这不仅可以揭示微生物组中的微生物多样性和抗生素耐药基因,还可以帮助检测病原体和疾病。从粪便样本采集开始,粪便分析的每个步骤都会被仔细完成,以确保准确的结果。这些步骤可能包括粪便采集、粪便样本保存、DNA和RNA提取,最后,进行PCR测试和/或测序等特定分析,以检测特定的微生物和生物标志物。

粪便核酸与水解酶之间的斗争
粪便样本中的核酸在采集后立即开始分解。是什么导致粪便中的DNA和RNA分解?脱氧核糖核酸酶(DNase)是负责通过水解其磷酸二酯骨架来切割DNA的酶5。同样,核糖核酸酶(RNase)是负责水解RNA中的3'和5'磷酸二酯键的酶6。这些酶存在于体内,用于调节免疫反应,保护身体免受感染等。它们还会分解细胞外的DNA和RNA,减少炎症并防止病毒感染传播。
当粪便排出体外时,DNase和RNase继续攻击样本中的DNA和RNA。2019年由张等人进行的研究发现,这导致DNA迅速降解,粪便DNA和RNA隔离质量较差,PCR扩增的成功率较低7。Norgen Biotek的粪便核酸产品对于粪便DNA和RNA的保存是最佳的选择,因为化学防腐剂可以灭活RNase和DNase,并为用户提供安全的、非传染性的粪便样本。
保存的作用:保存一个快照
粪便中的微生物在排出体外后仍在生长。问题在于它们在体外以不同的速度生长,而不像在体内时那样。这使得很难了解粪便排出体外时肠道微生物组的状态。保存粪便中微生物多样性的快照至关重要,以便正确评估肠道健康。此外,由于DNase和RNase的活性,粪便DNA和RNA非常敏感。

那么,存储粪便样本以防止核酸降解和不必要的微生物生长的最佳条件是什么呢?目前的黄金标准是在-80°C进行快速冷冻,因为它能够有效防止DNase和RNase活性以及微生物生长,但这并非始终可行的选择。8您可能没有达到如此低温度的冰柜,可能在没有冰柜的现场,而且粪便样本在运输过程中可能会受到温度波动的影响。那么,解决方案是什么呢?
为了解决这个问题,一种方法是消除对温度敏感的因素,并使用Norgen Biotek的粪便保存溶液。Norgen Biotek使用一种裂解性化学防腐剂,可以消除微生物的生长,以保持粪便的初始成分,同时稳定任何游离核酸,以防止降解。在室温下,这种防腐剂可以保护粪便DNA长达2年,粪便RNA长达7天。这样便于将样本运送至处理设施并无忧地进行存储。粪便防腐剂有几种不同的格式。最常用的防腐剂是在带有勺子的管状容器中,方便采集。"粪便核酸采集和保存系统"使用相同的管状容器,但通过提供丁腈手套和Fe-Col®收集纸,使在家中采集粪便更加方便。还有"粪便拭子采集和保存系统",顾名思义,设计成拭子格式,通常用于稀薄的粪便样本,以及从婴儿和各种哺乳动物采集的样本。"粪便DNA采集和保存迷你管"非常适合从小动物采集的小颗粒样本,并包含预装珠子,消除了将样本转移至不同管中进行珠子研磨的过程。
您的纯化DNA有多纯?
PCR测试是一种常用的分析DNA的技术。聚合酶链反应(PCR)可以放大纯化的粪便DNA,以更好地检测病原体。PCR通常也是元基因组测序库制备的第一步,在本文稍后将讨论这一步骤。
纯化的DNA通常没有您想象的那么纯。2009年,Oikarinen等人的一项研究发现,人类粪便中存在大量的PCR抑制剂,包括胆汁盐、多糖、蛋白质和腐殖酸。如果纯化方法未能充分去除这些抑制剂,它们可能会进入到分离的DNA中,从而干扰PCR放大过程。研究表明,这可能导致假阴性结果9。包括内部PCR对照有助于减少假阴性结果,这也是为什么Norgen基于Taqman PCR的病原体检测试剂盒始终包含内部对照,以确保准确的结果。此外,Norgen的粪便DNA分离试剂盒经过优化,可从宿主和微生物中分离DNA,这对于病原体检测至关重要,同时还能消除PCR抑制剂和其他污染物。这将产生高质量的DNA,适用于敏感的下游应用,如病原体检测和基因组测序。
相关产品推荐:
| 产品名称 | 货号 | 规格 |
| 粪便核酸采集和保存装置 Dx Stool Nucleic Acid Collection and Preservation Devices Dx | Dx45660 | 50 Devices |
| 粪便核酸采集和保存系统 Stool Nucleic Acid Collection and Preservation System | 63700 | 50 Devices |
| 粪便拭子采集和保存系统(散装规格) Fecal Swab Collection and Preservation System | 45670-B | 50 Units |
| 粪便核酸采集和保存管 Stool Nucleic Acid Collection and Preservation Tubes | 45660 | 50 管 |
| 粪便DNA收集和保存迷你管 Fecal DNA Collection & Preservation Mini Tubes | 27650 | 12 管 |
粪便DNA如何揭示肠道微生物组成
我们可以利用粪便DNA做什么,为什么应该研究它?除了用于病原体检测外,粪便DNA还可以用于分析肠道微生物组多样性,这有助于我们理解与疾病相关的关联。16S rRNA基因是在所有肠道微生物中发现的一种通用遗传标记,是核糖体机器的重要组成部分。它的序列包含高度保守的区域,所有细菌物种共享这些区域,同时还包含独特于每个物种的可变区域。这些序列变化使研究人员能够区分和识别微生物物种,使16S rRNA基因成为微生物组分析和分类的基石。将细菌群DNA经过定位于16S rRNA基因的NGS(下一代测序)后,研究人员可以识别和分类多样的细菌群。
健康状况、饮食、地理位置以及疾病治疗都可能改变微生物组的多样性。Righi等人于2022年发表的研究通过对COVID-19患者(2020年4月至2020年12月)的粪便样本进行16S rRNA测序,研究了COVID-19和抗生素治疗对肠道微生物组的影响。粪便样本收集并保存在-80°C,直到提取核酸。然后使用Norgen Biotek的粪便DNA分离试剂盒提取DNA并进行定量。最后,在放大16S rRNA基因V1-V3区域后进行16S rRNA测序。这项研究发现,COVID-19的严重程度与机会性细菌的增加呈正相关,同时减少了肠道中的有益细菌,如Agathobacter。COVID-19的严重程度是通过测量吸氧分数、炎症标志物(以及其他技术在文中使用的方法)来确定的。Agathobacter与吸氧分数呈负相关。另一方面,他们发现了大量的铜绿假单胞菌,这是一种与炎症标志物增加有关的常见机会性细菌10。
另一项来自2021年的研究利用粪便DNA探索肠道微生物组如何影响患有膀胱癌的患者对免疫疗法的治疗结果。癌细胞通过过度表达某些蛋白质来逃避免疫系统的攻击。免疫检查点抑制剂(ICIs)是一种阻断这些蛋白质的癌症治疗方法,使免疫系统能够杀死癌细胞。研究人员使用Norgen Biotek的粪便核酸采集和保存管收集了42名患者的粪便样本。他们使用Norgen Biotek的粪便DNA分离试剂盒从粪便样本中提取DNA,进行16S测序。他们发现,对ICIs治疗有反应的23名患者的肠道微生物多样性较高,而那些对治疗没有反应的患者则较低。他们得出结论,肠道微生物与患者对ICIs治疗的反应程度有关。根据以上讨论的研究和许多其他研究,粪便DNA可帮助我们调查宿主细胞中微生物多样性或遗传变异。然而,为了了解微生物以及宿主细胞中活跃的功能途径,我们需要研究粪便RNA。
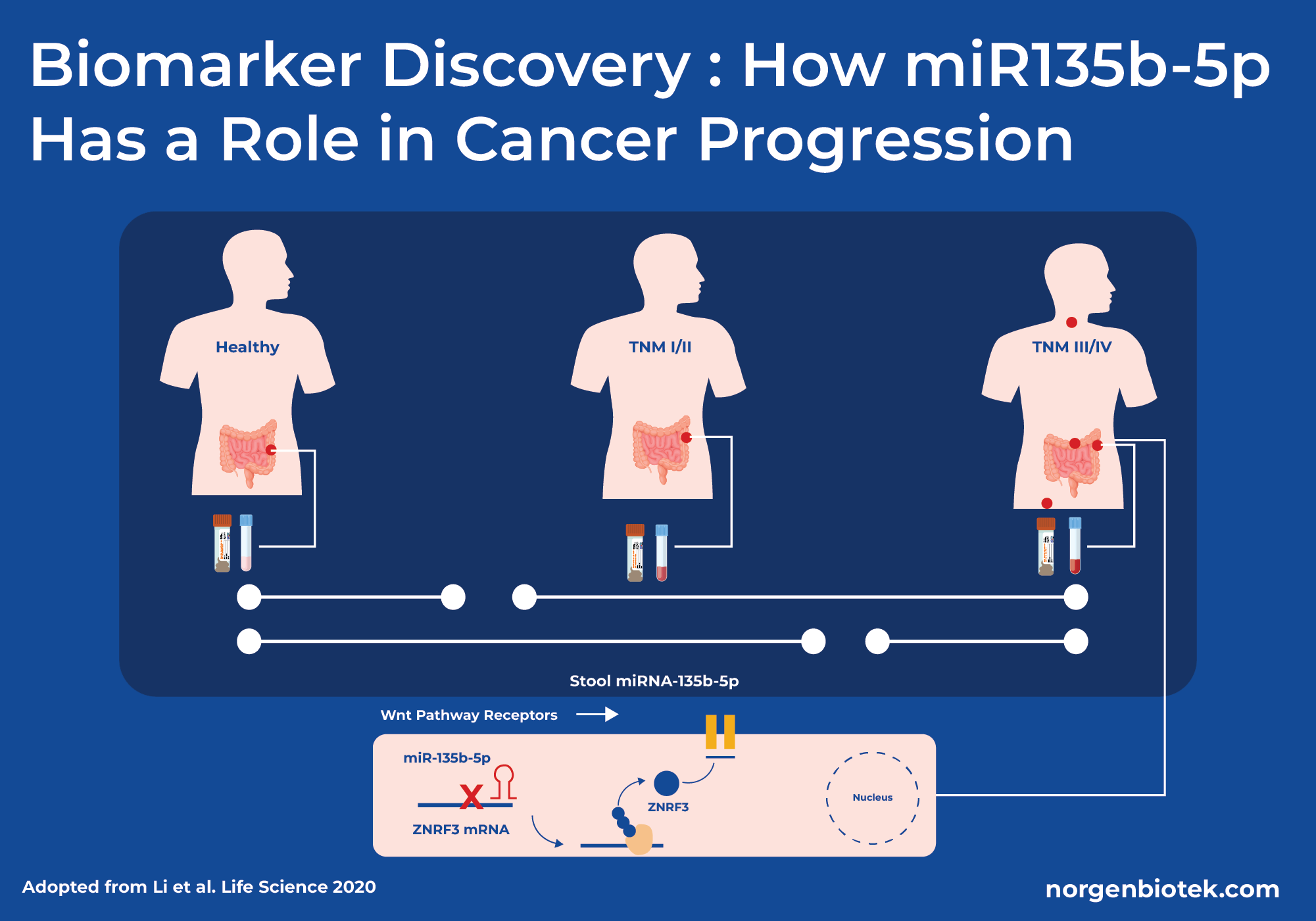
粪便RNA:癌症生物标志物发现的关键
粪便RNA分析提供了基因表达的广阔视角,包括微生物活动和宿主反应方面的见解。更深入地研究,粪便小RNA分析专注于较小的RNA分子,如微RNA(miRNA),在基因表达中发挥关键的调控作用,并提供有关宿主-微生物组相互作用和疾病过程的独特信息。这些小分子显示出在许多疾病包括癌症中作为生物标志物的巨大潜力,粪便miRNA可以成为检测结直肠癌的重要工具。miRNA是最小的RNA类型之一,需要高度优化的分离方法。幸运的是,Norgen的专有碳化硅技术不仅可以高效纯化高质量的miRNA,还可以类似效率和纯度地纯化大RNA,确保下游应用的可靠结果。
2020年一项研究探讨了从粪便样本中识别宿主miRNA(miR-135b-5p)作为结直肠癌的无创生物标志物。该研究包括77名结直肠癌患者和29名健康对照患者,并使用Norgen Biotek的粪便总RNA纯化试剂盒提取粪便RNA。研究团队随后对miR-135b-5p进行了定量实时PCR。研究发现,在结直肠癌患者中,miR-135b-5p上调,并且能够区分健康个体和结直肠癌患者。miR-135b-5p的上调有效降低了ZNRF3基因的蛋白表达水平。ZNRF3基因负责抑制WNT信号通路,这对于细胞生长和分化至关重要。ZNRF3蛋白表达的下调增加了WNT信号传导,导致癌症更快地扩散。总体而言,研究团队得出结论,从粪便样本中分离出的miR-135b-5p是一种有希望的生物标志物,可用于检测TNM(肿瘤、淋巴结、转移)分期III或IV阶段患者的结直肠癌。12

代谢组的奇妙:粪便还能告诉我们什么?
您知道吗?粪便样本可以用于分析短链脂肪酸(SCFAs)、多不饱和脂肪酸(PUFAs)和许多其他代谢物吗?SCFAs由结肠内的细菌产生,这些细菌将不可消化的多糖转化为醋酸、丙酸、丁酸等物质。SCFAs在黏液生产和维持肠道屏障完整性方面发挥着关键作用。14特别是丙酸等SCFAs与改善代谢健康密切相关。它们可以帮助调节葡萄糖和脂质代谢,16减少脂肪积累,17并增强胰岛素敏感性。18有些研究表明,SCFAs也可能在食欲调节中发挥作用,有助于体重管理。19相反,PUFAs并非在肠道内产生,而是通过富含健康脂肪的食物如油性鱼类和坚果获得。Ω-3和Ω-6是最常见的PUFAs类型,以其抗炎、血管收缩和抗氧化特性而闻名15。
2023年,Liam O'Neill等人研究了脂肪含量对肥胖手术患者肠道微生物组的影响。他们研究了肠道微生物组和肠道代谢物。研究团队使用Norgen Biotek的粪便核酸采集和保存管,从9名患者那里收集了手术前2周、手术时以及手术后1、3和6个月的粪便样本。由于Norgen的保护剂也与代谢组学研究兼容,他们能够进行30种脂肪酸的非靶向气相色谱-质谱联用(GC-MS)分析。研究发现,在摄入大量奶脂的患者中,如Roseburia、Christensenellaceae、Blautia和其他Bacteroides等细菌增加。这些细菌与减肥有关。例如,根据该研究,“Blautia通过产生丁酸和醋酸来降低肥胖”。他们还发现,“三名含有较高浓度饱和脂肪酸如肉豆蔻酸的患者是低奶脂消费者。另一方面,高奶脂消费者显示了非常高浓度的有益Ω-3多不饱和脂肪酸”。他们得出结论,奶脂的摄入增加了肠道中多不饱和脂肪酸和与减肥相关的细菌的存在13。
总的来说,粪便样本在各种检测、诊断和分析应用中发挥着至关重要的作用。从病原体鉴定到癌症检测,粪便为了解宿主整体健康提供了宝贵的见解。确保正确收集和保存粪便样本对于捕捉肠道微生物组的准确快照至关重要。艾美捷提供的Norgen Biotek致力于为研究人员和临床医生提供高质量的解决方案,涵盖粪便分析过程的每个步骤。从采集和保存到核酸提取和TaqMan PCR检测,旨在提供可靠准确的结果。
了解Norgen基于TaqMan的PCR试剂盒、16S和ITS文库制备试剂盒以及NGS服务如何提升您的研究和诊断工作流程。与我们合作,释放您的粪便分析之旅的全部潜力。让我们一起推动健康和发现科学的进步。
引用文章:
Jiang, C., Li, G., Huang, P., Liu, Z., & Zhao, B. The Gut Microbiota and Alzheimer's Disease. Journal of Alzheimer's Disease. 2017;58(1):1-15. https://doi.org/10.3233/JAD-161141
Turnbaugh, P. J., Ley, R. E., Hamady, M., Fraser-Liggett, C. M., Knight, R., & Gordon, J. I. The Human Microbiome Project. Nature. 2007;449(7164):804-810. https://doi.org/10.1038/nature06244
Guarner, F., & Malagelada, J.-R. Gut flora in health and disease. The Lancet, 2003;361(9356):512-519. https://doi.org/10.1016/s0140-6736(03)12489-0
Varela-Ramirez, A., Abendroth, J., Mejia, A. A., Phan, I. Q., Lorimer, D. D., Edwards, T. E., & Aguilera, R. J. Structure of acid deoxyribonuclease. Nucleic Acids Research, 2017;45(10):6217-6227. https://doi.org/10.1093/nar/gkx222
Eun, H.-M. (1996, January 1). 3 - Nucleases (H.-M. Eun, Ed.). ScienceDirect; Academic Press. https://www.sciencedirect.com/science/article/abs/pii/B9780122437403500065
Zhang, M., Wei, M., Dong, Z., Duan, H., Mao, S., Feng, S., Li, W., Sun, Z., Li, J., Yan, K., Liu, H., Meng, X., & Ge, H. (2019). Fecal DNA isolation and degradation in clam Cyclina sinensis: noninvasive DNA isolation for conservation and genetic assessment. BMC Biotechnology, 19(1). https://doi.org/10.1186/s12896-019-0595-6
bioz.com. (2024). Bioz Ratings For Life-Science Research. Bioz.com. https://www.bioz.com/articles/showDocs/?q=pmc08132403&uq=45660&v=PMC8132403&k=1dS238k0216N820MIp01&ix=45ad23
Oikarinen, S., Tauriainen, S., Viskari, H., Simell, O., Knip, M., Virtanen, S., & Hyöty, H. (2009). PCR inhibition in stool samples in relation to age of infants. Journal of Clinical Virology, 44(3), 211-214. Nature. 2007;449(7164):804-810. https://doi.org/10.1016/j.jcv.2008.12.017
Righi, E., Lambertenghi, L., Gorska, A., Sciammarella, C., Ivaldi, F., Mirandola, M., Sartor, A., & Tacconelli, E. (2022). Impact of COVID-19 and Antibiotic Treatments on Gut Microbiome: A Role for Enterococcus spp. Biomedicines, 10(11), 2786. https://doi.org/10.3390/biomedicines10112786
Filippo Pederzoli, Locatelli, I., Riba, M., Bandini, M., Raggi, D., Marandino, L., Alchera, E., Patrizia Giannatempo, Paolo Provero, Lazarevic, D., Lucianò, R., Gallina, A., Briganti, A., Montorsi, F., Salonia, A., Necchi, A., & Alfano, M. (2021). Stool microbiota profiling of patients with muscle invasive bladder cancer receiving neoadjuvant pembrolizumab. Journal of Clinical Oncology, 39(15_suppl), 4533–4533. https://doi.org/10.1200/jco.2021.39.15_suppl.4533
Li, L., Wang, A., Cai, M., Tong, M., Chen, F., & Huang, L. (2020). Identification of stool miR-135b-5p as a non-invasive diaognostic biomarker in later tumor stage of colorectal cancer. Life Sciences, 260, 118417-118417. https://doi.org/10.1016/j.lfs.2020.118417
O'Neill, L., Pandya, V., Grigoryan, Z., Patel, R., DeSipio, J., Judge, T., & Phadtare, S. (2021). Effects of Milkfat on the Gut Microbiome of Patients After Bariatric Surgery, a Pilot Study. Obesity Surgery. https://doi.org/10.1007/s11695-021-05805-z
Silva, Y. P., Bernardi, A., & Frozza, R. L. (2020). The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Frontiers in Endocrinology, 11(25). https://doi.org/10.3389/fendo.2020.00025
Adefegha, S. A., Oboh, G., & Oluokun, O. O. (2022, January 1). Chapter 11 - Food bioactives: the food image behind the curtain of health promotion and prevention against several degenerative diseases (Atta-ur-Rahman, Ed.). ScienceDirect; Elsevier. https://www.sciencedirect.com/science/article/abs/pii/B9780128239445000120
Todesco, T., Rao, A. V., Bosello, O., & Jenkins, D. J. (1991). Propionate lowers blood glucose and alters lipid metabolism in healthy subjects. The American journal of clinical nutrition, 54(5), 860-865.
Jiao, A., Yu, B., He, J., Yu, J., Zheng, P., Luo, Y., ... & Chen, D. (2021). Sodium acetate, propionate, and butyrate reduce fat accumulation in mice via modulating appetite and relevant genes. Nutrition, 87, 111198.
Pingitore, A., Chambers, E. S., Hill, T., Maldonado, I. R., Liu, B., Bewick, G., ... & Persaud, S. J. (2017). The diet-derived short chain fatty acid propionate improves beta-cell function in humans and stimulates insulin secretion from human islets in vitro. Diabetes, Obesity and Metabolism, 19(2), 257-265.
Frost, G., Sleeth, M. L., Sahuri-Arisoylu, M., Lizarbe, B., Cerdan, S., Brody, L., ... & Bell, J. D. (2014). The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nature communications, 5(1), 3611.



 经营性网站备案信息
经营性网站备案信息 鄂公网安备42018502007175
鄂公网安备42018502007175