美国疾病控制与预防中心报告称,仅在美国就有3400多万人患有糖尿病,另有8800万人患有前驱糖尿病。90%的糖尿病前期患者不知道自己的病情。如果不加以控制,前驱糖尿病和糖尿病会导致严重的健康问题,严重影响生活质量。好消息是,诊断和生活方式的改变可以将患2型糖尿病的风险降低一半。为了了解这些疾病的潜在机制并探索可能的治疗途径,研究人员测量和研究了各种蛋白质生物标志物的影响。
胰岛素原
胰岛素原是胰腺-细胞产生的一种前体分子,主要是对葡萄糖的反应,它被同样地分裂成胰岛素和c肽。胰岛素原水平升高与胰岛素瘤和胰岛素抵抗有关,而胰岛素原与胰岛素比值有助于阐明-细胞功能1,2。胰岛素原水平也是心血管风险的独立标志。一些研究表明,完整的胰岛素原有可能作为胰岛素抵抗的早期指标,在葡萄糖耐受不良的受试者中,完整的胰岛素原和中间体(des-31,32)的水平会变得不成比例地高。此外,他们建议空腹完整胰岛素原的测量可能有助于治疗选择和监测2型糖尿病的进展1,3。
胰岛素
胰岛素是胰岛内的-细胞在胰岛素原分裂时产生的一种激素。胰岛素向身体发出储存葡萄糖的信号,葡萄糖是血液中糖的主要类型,也是身体能量的主要来源,从而降低血糖水平。胰岛素与细胞壁上的特定受体结合,启动一系列复杂的过程,允许细胞摄取和使用刚好足够的葡萄糖来完成必要的功能4。胰岛素水平与许多疾病相关,包括胰岛素抵抗、糖尿病、高血压和代谢综合征。测量胰岛素使研究人员能够区分1型和2型糖尿病,预测糖尿病的风险,让患者参与预防计划,并监测糖尿病前期和胰岛素抵抗的进展。
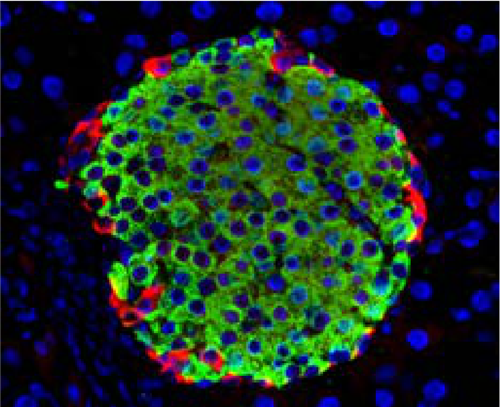
图1:胰岛细胞网染色。
C肽
胰岛素原分裂时,胰腺中产生C肽。C肽通常被用来代替胰岛素,因为它的比例是1:1,而且分解速度不那么快。C肽的半衰期约为30分钟,而胰岛素的半衰期约为3分钟,这使得C肽成为间接估计葡萄糖刺激的胰岛素分泌、了解?-细胞功能和识别?-细胞功能团的有吸引力的生物标志物。测量C肽水平类似于测量胰岛素水平,使研究人员能够区分1型糖尿病和2型糖尿病。最近,C肽显示出治疗糖尿病相关微血管并发症的潜力5,6 。此外,在1型糖尿病动物模型的研究中,给药C肽可显著改善神经和肾脏功能6。
胰高血糖素
胰高血糖素是胰岛内α-细胞在血糖水平低于正常水平时产生的一种肽激素,通常是对禁食或运动的反应7。胰高血糖素与肝脏一起将糖转化为葡萄糖,并释放到血液中,以支持增加的能量消耗并帮助维持能量稳态。此外,胰高血糖素减少食物摄入,可能在食欲调节中起作用8。胰高血糖素对糖尿病患者维持正常血糖至关重要,其测量有助于医生监测患者的血糖控制情况9。胰高血糖素水平升高也提示胰高血糖素瘤的存在,胰高血糖素瘤是一种罕见的分泌胰高血糖素的胰腺肿瘤:约80%的胰高血糖素瘤病例存在2型糖尿病10。
脂联素
脂联素(ADP)是一种脂肪来源的蛋白质,可以增加葡萄糖的使用,在预防胰岛素抵抗、糖尿病和动脉粥样硬化方面发挥重要作用。低ADP水平是2型糖尿病、肥胖和心血管疾病发展的一个指标11。虽然有几种ADP的同工异构体在循环中,但通常测量的是高分子量(HMW)、总ADP和HMW/总ADP的比值。研究表明,HMW值是胰岛素抵抗和代谢综合征最准确的预测指标12。此外,脂联素有许多治疗益处,包括增加胰岛素敏感性,减少炎症和动脉粥样硬化,在某些情况下还能减轻体重11。
瘦素
瘦素是一种由脂肪细胞产生的激素,它向身体发出停止进食的信号。瘦素减少饥饿感,帮助调节能量平衡。瘦素告诉大脑身体细胞中储存了多少脂肪。一般来说,瘦素水平的增加与脂肪的增加有关,而瘦素水平的降低与身体脂肪的减少有关。然而,大约5%的肥胖者瘦素水平非常高,这表明他们对这种激素缺乏敏感性,这种情况被称为瘦素抵抗13。作为治疗靶点,瘦素在减少热量摄入、增加体重减轻和改善胰岛素功能方面显示出价值14。
生长激素释放多肽(胃饥饿素)
胃饥饿素是一种主要由胃、小肠、胰腺和大脑在空腹时产生和释放的激素。胃饥饿素进入血液,向大脑发出饥饿的信号,从而刺激食欲,增加消耗,促进脂肪储存:它是唯一具有这种作用的循环激素。胃饥饿素在调节热量摄入和体脂水平方面起着关键作用,其水平表明营养状况和体脂储存13。其较高的水平与饥饿有关,而较低的水平与饱腹感有关。胃饥饿素具有广泛的治疗潜力,包括进食障碍、神经生成障碍、胃肠道疾病和代谢综合征15 。
肥胖抑制素
肥胖抑制素是一种由胃分泌的激素,存在于脾脏、乳腺、母乳和血浆中。肥胖抑制素表示饱腹感,抑制食欲,减少食物摄入,减少体重增加。循环肥胖抑制素水平通常与肥胖和糖尿病呈负相关16。肥胖抑制素水平也与1型糖尿病发病时的c肽和抗胰岛素抗体呈负相关,可能提示胰岛功能障碍17。
PYY 肽YY
PYY是一种由小肠分泌到血液中的激素,是对食物摄入的反应。PYY会向大脑发出吃饱了的信号,减缓消化,并在大约12小时内降低食欲。PYY的释放量取决于所吃食物的种类和数量18。高PYY水平与饮食失调、IBD和某些癌症等导致体重减轻的疾病有关。低PYY水平与食欲增加和体重增加有关,并与肥胖相关,使PYY成为治疗这种疾病的潜在治疗靶点19。
肌肉生长抑制素
肌肉生长抑制素是骨骼肌细胞在肌肉收缩时产生并释放的一种小蛋白质。骨骼肌是最大的胰岛素敏感器官。肌肉生长抑制素抑制骨骼肌生长。肌肉生长抑制素水平升高与肥胖、胰岛素抵抗和2型糖尿病的发展有关20。研究人员研究了肌肉生长抑制素如何抑制肌肉生长及其对葡萄糖摄取的影响。肌生长抑制素也是一种治疗靶点,因为抑制它可以改善肌肉力量和胰岛素敏感性21。
肠促胰岛素激素
肠促胰岛素是肠道内产生的激素,除其他功能外,还能增加胰腺的胰岛素分泌。“肠促胰岛素效应”指的是口服食物比注射葡萄糖能更好地刺激胰岛素的产生。换句话说,胰岛细胞对葡萄糖的直接反应与胰岛细胞对肠促胰岛素的反应相结合,使胰岛素的总输出最大化。肠促胰岛素如GIP,GLP-1和GLP-2产生这种效果。
葡萄糖依赖型胰岛素多肽(GIP)
GIP是一种肠促胰岛素,一种主要在小肠中产生的信号激素,是对葡萄糖、蛋白质或脂肪摄入的反应22,23。GIP刺激胰腺?-细胞在进食后释放胰岛素,促进脂肪组织中的能量储存。GIP受体也存在于α- 细胞中,在α- 细胞中,GIP刺激胰高血糖素释放,并通过旁分泌信号促进胰岛素分泌。GIP是高脂肪饮食( HFD)引起的肥胖和胰岛素抵抗的指标。
胰高血糖素样肽 (GLP-1)
GLP-1是一种肠促胰岛素激素,在肠道L细胞中产生,在食物摄入后刺激胰腺b细胞释放胰岛素。研究表明GLP-1对胰高血糖素分泌有调节作用,然而这些作用存在争议。以前,人们认为GLP-1抑制胰高血糖素分泌,但其潜在机制尚未得到很好的描述。最近的研究表明,GLP-1可以刺激或抑制胰高血糖素的分泌,这取决于葡萄糖水平或生理需要24。低水平的GLP-1是2型糖尿病的一个指标。GLP-1减少体重和食物摄入,减缓胃排空25。GLP-1也促进体重增加,因此是糖尿病和肥胖症的治疗靶点。在人体中,循环中的大部分GLP-1是活性GLP-1(7-36)形式26。
热销产品推荐(更多产品请咨询艾美捷):
检测指标 | 产品货号 | 产品名称 | 规格 |
胰岛素原 | ALP-82-PINHUI-E01 | Intact Proinsulin ELISA | 96 Wells |
ALP-82-PINHUT-E01 | Total Proinsulin ELISA | 96 Wells | |
胰岛素 | ALP-80-INSHU-E01.1 | Insulin ELISA | 96 Wells |
ALP-80-INSHU-E10.1 | Insulin ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSHUU-E01.1 | Insulin Ultrasensitive EIA (96 Wells), "IVD" | 96 Wells | |
ALP-80-INSHUU-E10 | Ultrasensitive Insulin ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSMS-E01 | Mouse Insulin ELISA | 96 Wells | |
ALP-80-INSMS-E10 | Mouse Insulin ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSMSH-E01 | Mouse High Range Insulin ELISA | 96 Wells | |
ALP-80-INSMSU-E01 | Mouse Ultrasensitive Insulin ELISA | 96 Wells | |
ALP-80-INSMSU-E10 | Mouse Ultrasensitive Insulin ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSRT-E01 | Rat Insulin ELISA | 96 Wells | |
ALP-80-INSRT-E10 | Rat Insulin ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSRTH-E01 | Rat High Range Insulin ELISA | 96 Wells | |
ALP-80-INSRTU-E01 | Insulin (Rat) Ultrasensitive, 96w, "RUO" | 96 Wells | |
ALP-80-INSMR-CH01 | Rodent Insulin Chemiluminescence ELISA | 96 Wells | |
ALP-80-INSMR-CH10 | Rodent Insulin Chemiluminescence ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-INSBO-E01 | Bovine Insulin ELISA | 96 Wells | |
ALP-80-INSHU-CH01 | Insulin Chemiluminescence ELISA | 96 Wells | |
ALP-80-INSHU-CH10 | Insulin Chemiluminescence ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
C-肽 | ALP-80-CPTHU-E01.1 | C-Peptide ELISA | 96 Wells |
ALP-80-CPTHU-E10 | C-Peptide ELISA Jumbo Pack (10 Plates) | 10 x 96 Wells | |
ALP-80-CPTMS-E01 | C-Peptide (Mouse) ELISA, 96 wells, "RUO" | 96 Wells | |
ALP-80-CPTRT-E01 | C-Peptide (Rat) ELISA, 96 wells, "RUO" | 96 Wells | |
ALP-80-CPTHU-CH01 | C-Peptide Chemiluminescence ELISA | 96 Wells | |
ALP-80-CPTHU-CH05 | C-Peptide Chemiluminescence ELISA Lab Pack (5 Plates) | 5 x 96 Wells | |
胰高血糖素 | ALP-11-GLUHU-E01 | Glucagon ELISA | 96 Wells |
ALP-48-GLUHUU-E01 | Glucagon Ultrasensitive EIA, 96w, "RUO" | 96 Wells | |
脂联素 | ALP-22-ADPMS-E01 | Mouse Total Adiponectin ELISA, 96-wells, RUO | 96 Wells |
ALP-22-ADPRT-E01 | Adiponectin (Rat) ELISA, 96 wells, "RUO" | 96 Wells | |
ALP-80-ADPHU-E01 | Human HMW &Total Adiponectin ELISA, 96 wells, "RUO" | 96 Wells | |
瘦素 | ALP-11-LEPHU-E01 | Leptin ELISA "RUO" | 96 Wells |
ALP-22-BLEPHU-E01 | Bioactive Leptin ELISA | 96 Wells | |
ALP-22-LEPHUU-E01 | Leptin Ultrasensitive ELISA, 96 wells, "RUO" | 96 Wells | |
ALP-22-LEPMS-E01 | Mouse/Rat Leptin EIA (96 wells), "RUO" | 96 Wells | |
GIP | ALP-48-AGIPHU-E01 | Active GIP ELISA | 96 Wells |
ALP-48-AGIPMS-E01 | Mouse Active GIP ELISA | 96 Wells | |
ALP-48-AGIPRT-E01 | Rat Active GIP ELISA | 96 Wells | |
ALP-48-GIPHU-E01 | Total GIP ELISA | 96 Wells | |
ALP-48-GIPMS-E01 | Mouse Total GIP ELISA | 96 Wells | |
ALP-48-GIPRT-E01 | Rat Total GIP ELISA | 96 Wells | |
GLP-1 | ALP-43-GP1HU-E01 | GLP-1 (Active 7-36) ELISA, 96 wells "RUO" | 96 Wells |
ALP-43-GPTHU-E01 | GLP-1 (7-36 and 9-36) ELISA, 96 wells | 96 Wells | |
ALP-80-GLP1A-CH01 | Active GLP-1 (7-36) amide Chemiluminescence ELISA | 96 Wells | |
GLP-2 | ALP-48-GP2HU-E01.1 | GLP-2 EIA "RUO" | 96 Wells |
ALP-48-GP2MS-E01 | GLP-2 (Mouse) EIA "RUO" | 96 Wells | |
ALP-48-GP2RT-E01 | GLP-2 (Rat) EIA "RUO" | 96 Wells | |
PYY | ALP-48-PYYHU-E01.1 | PYY EIA, "RUO" | 96 Wells |
ALP-48-PYYRT-E01.1 | PYY (Rat) EIA "RUO" | 96 Wells |
引文:
1. Kim, et al (2000). Serum Insulin, Proinsulin and Proinsulin/Insulin Ratio in Type 2 Diabetic Patients: As an Index of β-Cell Function or Insulin Resistance. Korean J Intern Med. Dec;15(3):195-201. PMCID: PMC4531777.
2. Guettier, et al (2013). The Role of Proinsulin and Insulin in the Diagnosis of Insulinoma: A Critical Evaluation of the Endocrine Society Clinical Practice Guideline J Clin Endocrinol Metab. Dec;98(12):4752–4758. doi: 10.1210/jc.2013-2182.
3. Pfutzner, et al (2011). Elevated Intact Proinsulin Levels are Indicative of Beta-cell dysfunction, Insulin resistance, and Cardiovascular Risk: Impact of Antidiabetic Agent Pioglitazone. Journal of Diabetes Science and Technology. May 1;5(3):784-793. PMCID: PMC3192645.
4. Wilcox (2005). Insulin and Insulin Resistance. Clin Biochem Rev. May;26(2):19–39. PMCID: PMC1204764.
5. Bhatt, et al (2014). C-peptide replacement therapy as an emerging strategy for preventing diabetic vasculopathy. Cardiovasc Res. Nov 1;104(2):234-44. DOI: 10.1093/cvr/cvu211.
6. Sima, et al (2001). C-peptide prevents and improves chronic Type I diabetic polyneuropathy in the BB/Wor rat. Diabetologia. Jul 44 (7):889-97.PMID 11508275.
7. Drucker and Nauck (2006). The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet. Nov 11;368(9548):1696-705. DOI: 10.1016/S0140-6736(06)69705-5.
8. Tan, et al (2013). Co-administration of glucagon-like peptide-1 during glucagon infusion in man results in increased energy expenditure and amelioration of hyperglycemia. Diabetes Apr;62(4):1131–1138. PMCID: PMC3609580.
9. Drucker and Campbell (2015). Islet α-cells and glucagon - critical regulators of energy homeostasis. Nature Reviews Endocrinology Jun;11(6):329-339. DOI: 10.1038/nrendo.2015.51.
10. Sandhu and Jialal, Stat Pearls. Glucagonoma Syndrome. StatPearls Publishing; 2021 Jan. Last Update: September 28, 2021.
11. Arunkumar, et al (2017). Adiponectin, a Therapeutic Target for Obesity, Diabetes, and Endothelial Dysfunction. Int J Mol Sci. Jun;18(6):1321.PMID: 28635626.
12. Hara K, et al (2006). Measurement of the high molecular weight form of adiponectin in plasma is useful for the prediction of insulin resistance and metabolic syndrome. Diabetes Care. Jun;29(6):1357-62. DOI: 10.2337/dc05-1801.
13. Austin and Marks (2009). Int J Pediatr Endocrinol. Hormonal Regulators of Appetite. 2009;2009:141753. PMID: 19946401.
14. Samuel and Schulman (2016). The pathogenesis of insulin resistance: Integrating signaling pathways and substrate flux. J. Clin. Invest. Jan;126(1):12-22. PMCID: PMC4701542.
15. Collden, et al (2017). Therapeutic Potential of Targeting the Ghrelin Pathway. Int J Mol Sci. Apr;18(4):798. PMID: 28398233.
16. Cowan, et al (2016). Obestatin as a key regulator of metabolism and cardiovascular function with emerging therapeutic potential for diabetes. Br J Pharmacol. Jul;173(14):2165-81. PMCID: PMC4919582.
17. Prodam, et al (2014). Obestatin levels are associated with C-peptide and anti-insulin antibodies at the onset whereas unacylated and acylated ghrelin levels are not predictive of long-term metabolic control in children with type 1 diabetes. J Clin Endocrinol Metab. Apr;99(4):E599-607. DOI: 10.1210/jc.2013-3294.
18. Helou, et al (2008). Variation of postprandial PYY 3-36 response following ingestion of differing macronutrient meals in obese females. Ann Nutr Metab, Jun 11:52(3):188-95. DOI: 10.1159/000138122.
19. Karra, et al (2008). The role of peptide YY in appetite regulation and obesity. J Physiol. Jan 1; 587(Pt 1): 19–25. PMID: 19064614.
20. Amor, et al (2019). Serum Myostatin is Upregulated in Obesity and Correlates with Insulin Resistance in Humans. Exp Clin Endocrinol Diabetes. Sep;127(8):550-556. DOI: 10.1055/a-0641-5546.
21. Eilers, et al (2020). Local myostatin inhibition improves skeletal muscle glucose uptake in insulin-resistant high-fat diet-fed mice. Jun 29. American Journal of Physiology-Endocrinology and Metabolism. Vol. 319, No. 1. https://doi.org/10.1152/ajpendo.00185.2019.
22. Campbell and Drucker (2013). Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metabolism. Jun 4;17(6):819-837. DOI: 10.1016/j.cmet.2013.04.008.
23. Baggio and Drucker (2007). Biology of incretins GLP-1 and GIP. Gastroenterology. May;132(6):2131-57. DOI: 10.1053/j.gastro.2007.03.054.
24. Zhang, et al (2019). GLP-1 Receptor in Pancreatic a-Cells Regulates Glucagon Secretion in a Glucose-Dependent Bidirectional Manner. Diabetes Jan;68(1):34-44. https://doi.org/10.2337/db18-0317.
25. Drucker (2018). Mechanisms of action and therapeutic application of Glucagon-like Peptide-1. Cell Metabolism. Apr 3;27(4):740-756. DOI:10.1016/j.cmet.2018.03.001.
26. Nadkarni, et al (2014). Regulation of glucose homeostasis by GLP-1. Prog Mol Biol Transl Sci. 121:23-65. PMCID: PMC4159612.



 经营性网站备案信息
经营性网站备案信息 鄂公网安备42018502007175
鄂公网安备42018502007175